Продовжуємо публікувати інформацію щодо безпеки лікарських засобів (далі -ЛЗ), вакцин/туберкуліну за результатами роботи Управлінням фармаконагляду Державного експертного центру МОЗ.
Всесвітня організація охорони здоров’я (далі – ВООЗ) визначає фармаконагляд, як науку та комплекс заходів щодо виявлення, оцінки, розуміння та попередження розвитку побічних реакцій (далі – ПР) або будь-яких інших несприятливих явищ, пов’язаних із застосуванням ЛЗ. В Україні, як і у більшості країн, відповідальність за здійснення моніторингу за безпекою ЛЗ в післяреєстраційний період покладена на заявника (власника реєстраційного посвідчення), з одного боку, а з іншого – на регуляторний орган, що контролює здійснення фармаконагляду на державному рівні, а саме, на Державний експертний центр МОЗ (далі – Центр).
Протягом першого півріччя 2020 року на офіційному сайті Державного експертного центру МОЗ (далі–Центр) за посиланням https://dec.gov.ua/applicant/2019/?role=applicant заявникам та https://dec.gov.ua/doctors/2019-listi-zvernennya-do-medichnih-ta-farmaczevtichnih-praczivnikiv/?role=doctors медичним працівникам було оприлюднено 28 повідомлень з безпеки застосування ЛЗ на підставі рішень та рекомендацій міжнародних європейських агентств та 1 повідомлення Управління з контролю за продуктами харчування та ліками (FDA). Рекомендації стосувались змін та доповнень до інструкцій для медичного застосування ЛЗ щодо показань, протипоказань, дозування, ПР, особливостей застосування, тощо. Ці рекомендації були підставою для відповідних дій заявників ЛЗ, з метою попередження виникнення нових ризиків для пацієнта. Так, Європейською комісією було видано рішення про розширення протипоказань при застосуванні ЛЗ Lemtrada (діюча речовина Alemtuzumab), про внесення змін до Xeljanz (Tofacitinib) щодо підвищеного ризику утворення тромбів у легенях та глибоких венах у пацієнтів, які вже мають високий ризик тромбоутворення, обмеження щодо використання окремих лікарських форм Fosfomycin та інші. Через тяжкі пошкодження печінки, щодо ulipristal acetate Gedeon Richter, Комітет з оцінки ризиків (PRAС) рекомендовав тимчасово на період розгляду припинити дію РП. Стосовно thiazide, thiazide-подібних діуретиків та комбінацій PRAC рекомендував внести зміни щодо можливості виникнення хоріоїдального випіту, як ПР. Комітет з лікарських засобів для людини (CHMP) рекомендовав припинити дію реєстраційного посвідчення (РП) всіх препаратів ранітидину (Ranitidine) через наявність низких рівней домішки N- нитрозодиметиламин (NDMA). Також CHMP стосовно fluorouracil, capecitabine, tegafur надано рекомендації пацієнтам пройти тестування на відсутність ферменту під назвою дигідропіримідиндегідрогеназа (DPD) перед початком лікування раку ЛЗ, що містять фторурацил. Це лише деякі приклади рекомендацій європейських агентств, щодо змін до інструкцій для медичного застосування ЛЗ.
Також було оприлюднено 14 повідомлення про сигнали, що сформовані за даними глобальної бази даних ВООЗ VigiBase. Прикладом таких сигналів була інформація про взаємозв’язок між інгібіторами фактору некрозу пухлин (infliximab, etanercept and adalimumab) та виникненням індукованого плевроперикардиту та лімфоматоїдного папульозу. Також сформовано сигнал стосовно застосування Capsaicin щодо випадків гіперчутливості при повторному впливі та можливості виникнення хронічної форми гіперчутливості у медичних працівників, які проводять маніпуляціїї пацієнтам цими ЛЗ. Ще одним прикладом сформованого сигналу, є інформація про взаємозв’язок між Tocilizumab та виникненням шлунково-кишкової перфорації. Усі ці дані, у подальшому, будуть враховані, як заявниками, так і регуляторним органом у процесі внесення змін до інструкцій для медичного застосування, реєстрації та перереєстрації лікарських засобів. Також вони будуть враховані при створенні регулярних звітів з безпеки та планів управління ризиками.
На підставі відомої інформації з безпеки ЛЗ заявниками було розроблено 40 листів – звернень до спеціалістів охорони здоров’я та пацієнтів, що були оприлюднені на офіційному сайті Центру за посиланнями https://dec.gov.ua/doctors/2019-listi-zvernennya-do-medichnih-ta-farmaczevtichnih-praczivnikiv/?role=doctors та https://dec.gov.ua/patient/2019/?role=patient.
За висновками PRAC на підставі оцінки аналізу регулярно оновлюванних звітів з безпеки та аналізу регулярних звітів з безпеки, що надходять до Центру, на офіційному сайті Центру було оприлюднено 13 повідомлень з інформацією з безпеки застосування ЛЗ. Наприклад, у висновку PSUSA щодо Erythromycin рекомендовані зміни до розділу: «Протипоказання» – не слід давати пацієнтам: які мають в анамнезі пролонгації QT або шлуночкову аритмію серця; з порушеннями електроліту (гіпокаліємія, гіпомагнезіємія через ризик подовження інтервалу QT), до розділу «Побічні реакції» – щодо зупинки серця, шлуночкової фебриляції, до розділу «Особливості застосування» – пілоростеноз, щодо розділу «Взаємодія з іншими лікарськими засобами та інші види взаємодій» – підвищений ризик виникнення кровотечі після взаємодії з лікарськими засобами, що містять ривароксабан. Щодо Pitavastatin у висновку PSUSA рекомендовано внесення змін до інструкції у розділ: “Побічні реакції” – запаморочення. Стосовно Ropinirole – щодо внесення змін до інструкції у розділ «Особливості застосування» щодо фактору ризику синдрому відміни агоніста допаміну (DAWS). У цих повідомленнях було надано рекомендації щодо внесення змін до інструкцій для медичного застосування ЛЗ, що містять діючі речовини, стосовно яких було оприлюднено інформацію за посиланням https://dec.gov.ua/applicant/2019/?role=applicant.
Протягом першого півріччя 2020 року через Автоматизовану інформаційну систему з фармаконагляду (далі – АІСФ) до Центру надійшло 9080 повідомлень про випадки ПР та/або відсутності ефективності (далі – ВЕ) ЛЗ при їх медичному застосуванні та несприятливі події після імунізації при застосуванні вакцин/туберкуліну. Переважна більшість повідомлень надійшла від медичних працівників, які надають перевагу внесенню інформації в режимі on-line через АІСФ.
На підставі даних АІСФ у Діаграмі 1 представляємо частку, отриманих у першому півріччі 2020 рока повідомлень про ПР для 7 з 15 фармакотерапевтичних груп лікарських засобів першого рівня анатомо-терапевтично-хімічної класифікації (далі -АТХ).
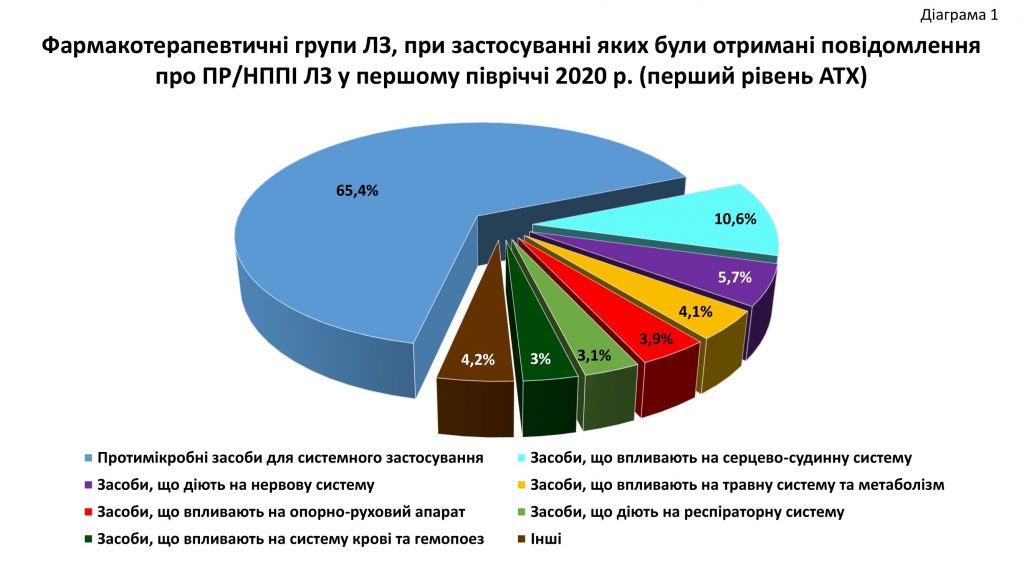
Залишається незмінним перевага повідомлень про ПР при застосуванні протимікробних засобів для системного застосування (65,4%). Такі ж показники спостерігались і у 2019 році. Загалом розподіл фармакотерапевтичних груп ЛЗ залишається незмінним за усі останні роки. У порівнянні із протимікробними засобами для системного застосування, інформація про ПР на усі інші групи за першим рівнем АТХ до Центру надходить у рази менше. Дещо різниця частка повідомлень при застосуванні засобів, що впливають на серцево-судинну систему (10,6%), тоді як повідомлення про ПР при застосуванні засобів, що діють на нервову систему, травну систему та метаболізм, опорно-руховий апарат, респіраторну систему, систему крові та гемопоез займають відповідно: 5,7%, 4,1%, 3,9%, 3,1%, 3%. Усі інші фармакотерапевтичні групи ЛЗ займають 4,2%.
На Діаграмі 2 за даними АІСФ представлено 10 фармакотерапевтичних груп лікарських засобів другого рівня класифікації АТХ з 86, при застосуванні яких отримано найбільшу кількість повідомлень про ПР протягом першого півріччя 2020 року.
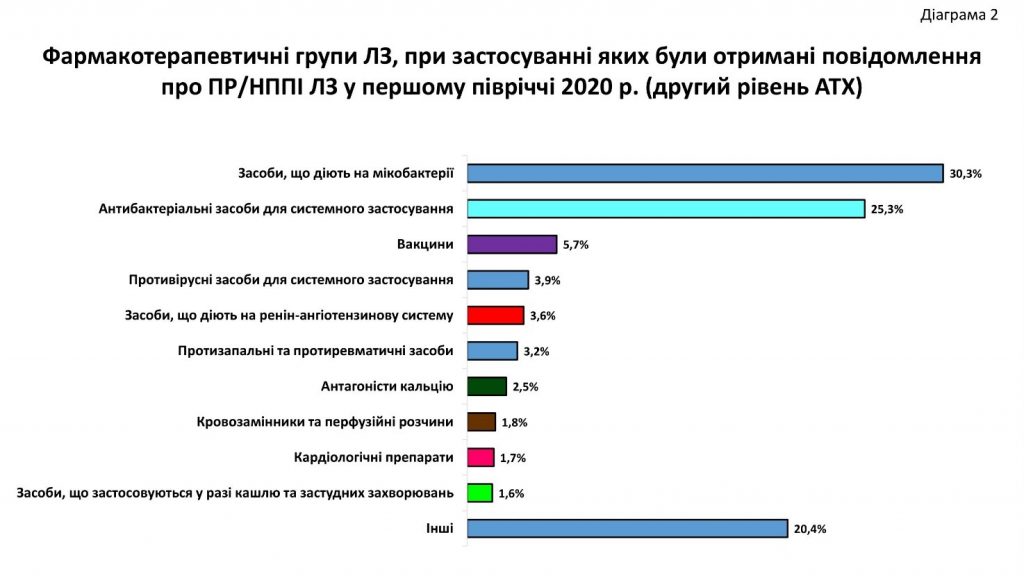
Найбільша частка повідомлень про ПР стосувалась застосування лікарських засобів, що діють на мікобактерії та антибактеріальні засоби для системного застосування. Ці дві фармакотерапевтичні групи займають майже половину усіх повідомлень, що надійшли до Центру. Повідомлення про НППІ при застосуванні вакцин становили 5,7%. Частка повідомлень при застосуванні противірусних засобів для системного застосування, засобів, що діють на ренін-ангіотензивну систему, протизапальних та протиревматичних засобів становить, відповідно: 3,9%, 3,6%, 3,2%. Частка повідомлень про ПР при застосуванні інших ЛЗ становила менше 3,2%. Серед загальної кількості отриманих повідомлень про випадки ПР у першому півріччі 2020 року за ступенем серйозності несерйозні ПР становили 93,45% серйозні – 6,55%. Частота серйозних ПР за причинами серйозності складала: 0,84% – смерті, 20,97% – загрози життю, 19,13% – госпіталізації амбулаторних пацієнтів, 38,93% – подовження термінів госпіталізації, 1,68% – тривала непрацездатність, 0,50% – інвалідність та 17,95% інші медично важливі стани здоров’я.
За звітній період до Центру надійшла інформація про два випадки смерті внаслідок анафілактичного шоку.
Анафілактичні шоки виникали після застосування одного або групи препаратів, що були застосовані одночасно в умовах медичних закладів.
Один з випадків стався у жінки в умовах палати інтенсивної терапії у післяпологовому періоді при застосуванні кровозамінника з метою поповнення кровообігу. Прояви анафілактичного шоку спостерігались відразу після застосування підозрюваного ЛЗ. Не дивлячись на проведені реанімаційні заходи, пацієнтка померла через годину після введення кровозамінника.
Другий випадок стався у дівчинки в умовах операційної підчас введення чотирьох ЛЗ для загального знеболення при проведенні операції по видаленню апендициту. Через 7 хвилин після введення усіх підозрюваних ЛЗ у пацієнтки було зафіксовано ознаки анафілактичного шоку. Через три години після проведених неефективних реанімаційних заходів, було констатовано біологічну смерть пацієнтки.
Треба зазначити, що із року в рік, основною та переважною причиною смерті пацієнтів в наслідок застосування ЛЗ, є важкі прояви анафілактичного шоку, які не піддавалися медикаментозній корекції.
За перше півріччя 2020 року частка передбачених повідомлень про ПР, що надійшли до Центру становила 97,45% від загальної кількості повідомлень. Непередбачені повідомлення становили лише 0,01%. Це стосується одного випадку непередбаченої ПР при застосуванні ЛЗ Натрію хлориду 0,9%. Клінічними проявами ПР були озноб, слабкість, затруднене дихання, відчуття важкості у грудях. ЛЗ було самостійно придбано пацієнтом у аптеці. У подальшому лікуванні підозрюваний ЛЗ не застосовувався.
За гендерними особливостями розподіл випадків ПР у першому півріччі 2020 року характеризується незначною перевагою випадків у чоловіків (42,13%), жінки становили 38,92%. Інформація про ПР у дівчат та хлопців надходили у рівній кількості (7,22% та 7,48%). Найбільш вразливою групою є пацієнти у віці 31-45 років. Найменше повідомлень про ПР надходило про пацієнтів у віці старше 80 років. Найменший відсоток випадків ПР відмічався у дітей від 0 до 27 днів (0,09%) та у дітей 12-17 років (0,91%).
У зв’язку із пандемією коронавірусу COVID 19, на особливому контролю були повідомлення про ПР при застосуванні ЛЗ, що застосовувались в лікуванні цього захворювання. В Україні було затверджено наказ МОЗ України від 02.04.2020 № 762 (у редакції наказу МОЗ України від 10.04.2020 № 852) «Про затвердження протоколу «Надання медичної допомоги для лікування коронавірусної хвороби (COVID-19)»» (далі – Протокол). Враховуючи рекомендовані у Протоколі ЛЗ, що призначалися за іншими показаннями або були не зареєстровані в Україні, Центр проводив ретельний контроль за випадками ПР на ці ЛЗ не тільки в Україні, а і Європі та США. Аналіз таких випадків систематично оприлюднювався на офіційному сайті Центру у розділі Фармаконагляд. Було оприлюднено 8 публікацій «Аналіз спонтанних повідомлень про випадки побічних реакцій, що пов’язані із застосуванням лікарських засобів при лікуванні COVID-19, та надійшли до VigiBase проміжні результати» за різні періоди спостереження, починаючи з квітня 2020 року. Двічі публікувались звіти з аналізом повідомлень від заявників про випадки ПР, що пов’язані із застосуванням ЛЗ при лікуванні COVID19, та надійшли до Центру. Також було оприлюднено великий підсумковий огляд даних з безпеки ЛЗ, що містять гідроксихлорохін та хлорохін під час лікування COVID-19 Управлінням з контролю за харчовими продуктами та лікарськими засобами США (FDA). Дана інформація є необхідною для з’ясування питань безпеки та ефективності ЛЗ, оцінки співвідношення користь/ризик та доцільності їх подальшого застосування у хворих на коронавірусну інфекцію.
Із узагальненою щоквартальною інформацією про випадки ПР при застосуванні вакцин в Україні, можна ознайомитись на офіційному сайті Центру за посиланням https://dec.gov.ua/doctors/rezultati-diyalnosti-z-pitan-bezpeki-likarskih-zasobiv/?role=doctors.