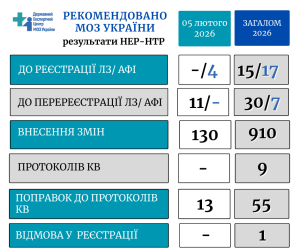
05 лютого в Центрі відбулося засідання науково-технічної ради. За результатами експертизи реєстраційних матеріалів, що надходять за процедурами реєстрації, перереєстрації, внесення змін, матеріалів клінічних випробувань лікарських засобів – рішенням НТР рекомендовано надати МОЗ України:
- до реєстрації – 4 субстанції (АФІ)
- до перереєстрації – 11 лікарських засобів
- внесення змін у реєстраційні матеріали – 130 ЛЗ
- поправок до протоколів міжнародних багатоцентрових клінічних випробувань ЛЗ – 13.
Загалом з початку року ДЕЦ надав профільному міністерству більше 1000 експертних висновків щодо державної реєстрації ліків в Україні та проведення клінічних випробувань. Більш детально – у інфографіці: