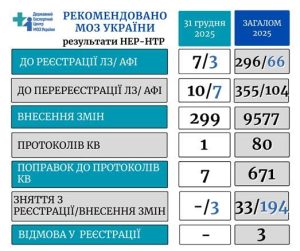
31 грудня 2025 року у Центрі під головуванням директора Михайла Бабенка та заступниці директора з питань реєстрації та аудиту Олени Семенченко відбулися останні передноворічні засідання науково-експертної та науково-технічної рад. За результатами МОЗ України надано 344 експертних рекомендацій у сфері державної реєстрації лікарських засобів та клінічних випробувань. А саме:
- у сфері державної реєстрації лікарських засобів:
- до реєстрації – 7 ЛЗ та 3 АФІ
- до перереєстрації – 10 ЛЗ та 7 АФІ
- внесення змін у реєстраційні матеріали – 299 ЛЗ
- до зняття з розгляду реєстраційних матеріалів на етапах експертизи – 3
- у сфері клінічних випробувань:
- до затвердження міжнародних багатоцентрових КВ – 1
- поправок до протоколів міжнародних багатоцентрових клінічних випробувань ЛЗ – 7.
Загалом протягом 2025 року Центром було проведено 31 засідання науково-експертної та 48 засідань науково-технічної рад. За результатами профільному міністерству надано більше 11 400 експертних висновків.
Серед ключового рекомендовано:
- зареєструвати в Україні – майже 300 позицій лікарських засобів та 66 субстанцій
- перереєструвати – понад 350 ЛЗ та 100 АФІ
- внести зміни у реєстраційні матеріали – на понад 9,5 тис. лікарських засобів
- дозволити проведення 80 клінічних досліджень як від міжнародних, так і вітчизняних спонсорів.
- внести поправки до більш як 670 матеріалів клінічних випробувань.
Напрацювання свідчать про високу інтенсивність та відповідальність експертної діяльності Центру. Ця робота буде послідовно продовжена і в 2026 році – для безперебійного забезпечення пацієнтів якісними, ефективними і безпечними лікарськими засобами та сталого функціонування системи охорони здоров’я України.