460 нових рекомендацій у сфері державної реєстрації лікарських засобів та клінічних випробувань – результати засідань НЕР/НТР Центру від 25.04.2024
25 квітня у ДЕЦ відбулися чергові засідання науково-експертної та науково-технічної рад під головуванням директора Центру Михайла Бабенка та заступниці директора з питань реєстрації та фармаконагляду Євгенії Ішкової.
За результатами розгляду реєстраційних матеріалів, поданих до державної реєстрації, перереєстрації лікарських засобів, внесення змін у реєстраційні матеріали, затвердження матеріалів клінічних випробувань, цього тижня Центр рекомендував:
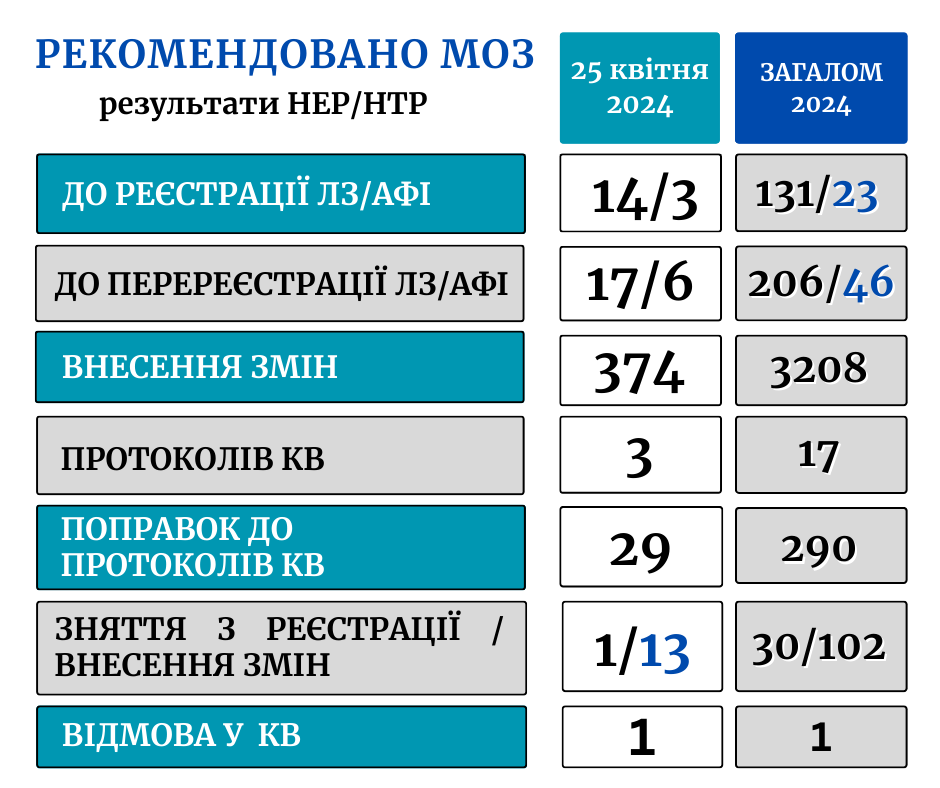
- до реєстрації – 14 ЛЗ (3 вітчизняного, 11 зарубіжного виробництва) – препарати, що застосовуються в кардіології, урології, неврології, фтизіатрії, психіатрії та інші;
- до реєстрації АФІ – 3;
- до перереєстрації ЛЗ (на необмежений термін) – 17;
- до перереєстрації АФІ – 6;
- до внесення змін у реєстраційні матеріали – 374 ЛЗ (363 зміни + 11 технічні помилки);
- зняття з процедури реєстрації – 1 ЛЗ
- зняття з розгляду на різних етапах експертизи – 13 ЛЗ.
За результатами експертизи матеріалів щодо клінічних випробувань лікарських засобів рекомендовано:
- до затвердження проведення міжнародних багатоцентрових клінічних випробувань – 2 КВ (терапевтична група – онкологія);
- до затвердження проведення вітчизняних клінічних випробувань – 1 КВ (дослідження біоеквівалентності ЛЗ)
- поправок до протоколів міжнародних багатоцентрових КВ ЛЗ – 29 ( у т.ч. щодо лікування короновірусної хвороби – 2).
Також під час засідання НЕР було розглянуто та схвалено методичні рекомендації «Особливості проведення клінічних досліджень лікарських засобів для лікування нетримання сечі». З доповіддю виступила начальник Відділу клінічного аудиту клінічних випробувань Центру Леся Янкова.